El 5 de julio, Novo Nordisk lanzó un ensayo clínico de fase III de la inyección de CagriSema en China, cuyo objetivo es comparar la seguridad y eficacia de la inyección de CagriSema con semeglutida en pacientes obesos y con sobrepeso en China.
La inyección de CagriSema es una terapia combinada de acción prolongada que está desarrollando Novo Nordisk; los componentes principales son la esmeglutida, agonista del receptor del GLP-1 (péptido similar al glucagón-1), y la cagrilintida, un análogo de amilina de acción prolongada.La inyección de CagriSema se puede administrar por vía subcutánea una vez a la semana.
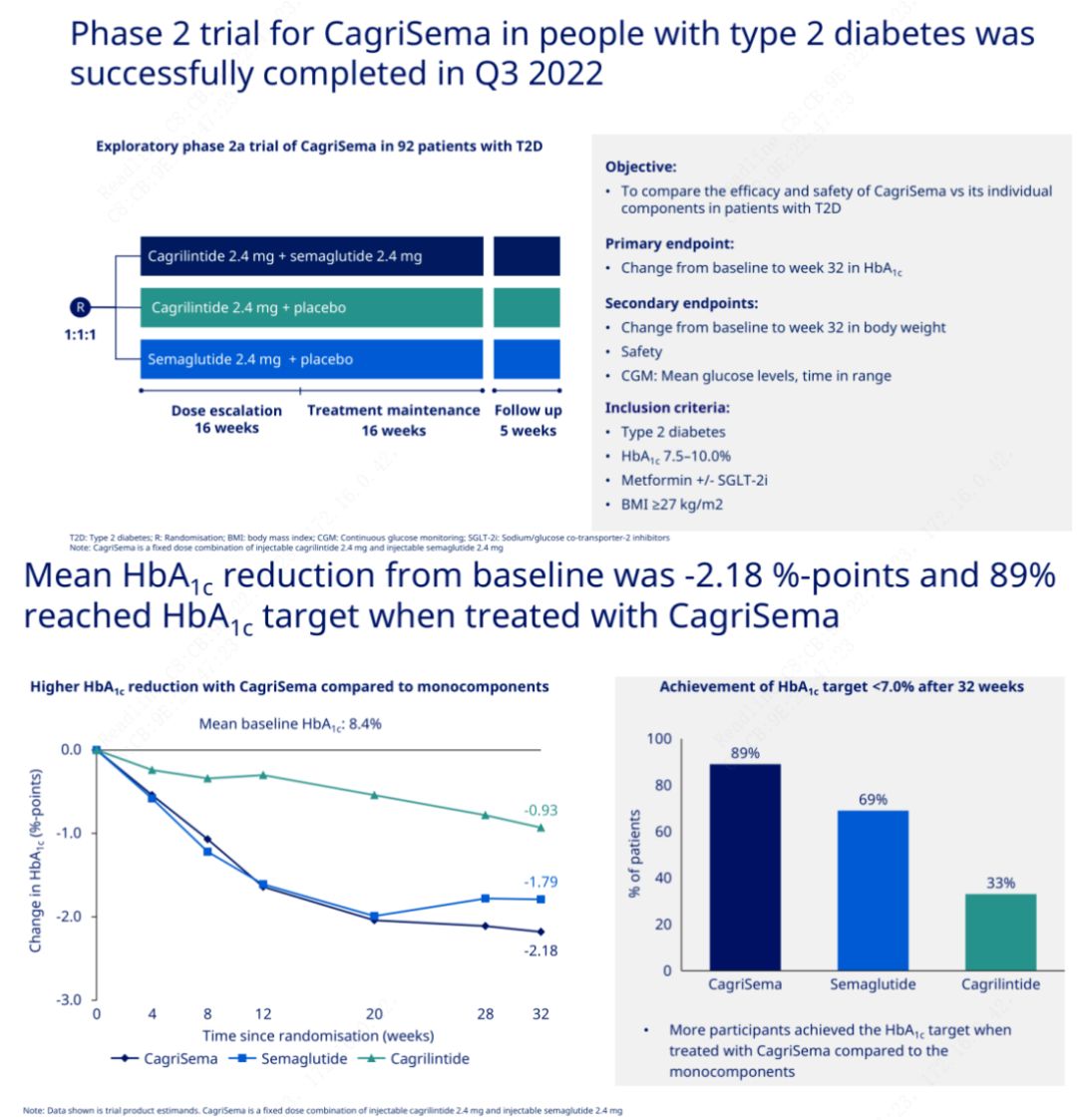
El objetivo principal fue comparar CagriSema (2,4 mg/2,4 mg) con semeglutida o placebo una vez a la semana por vía subcutánea.Novo Nordisk ha anunciado los resultados de un ensayo de CagriSema para el tratamiento de la diabetes en etapa 2, que demostró que el efecto hipoglucemiante de CagriSema es mejor que el de la semeglutida, y casi el 90% de los sujetos alcanzaron el objetivo de HbA1c.
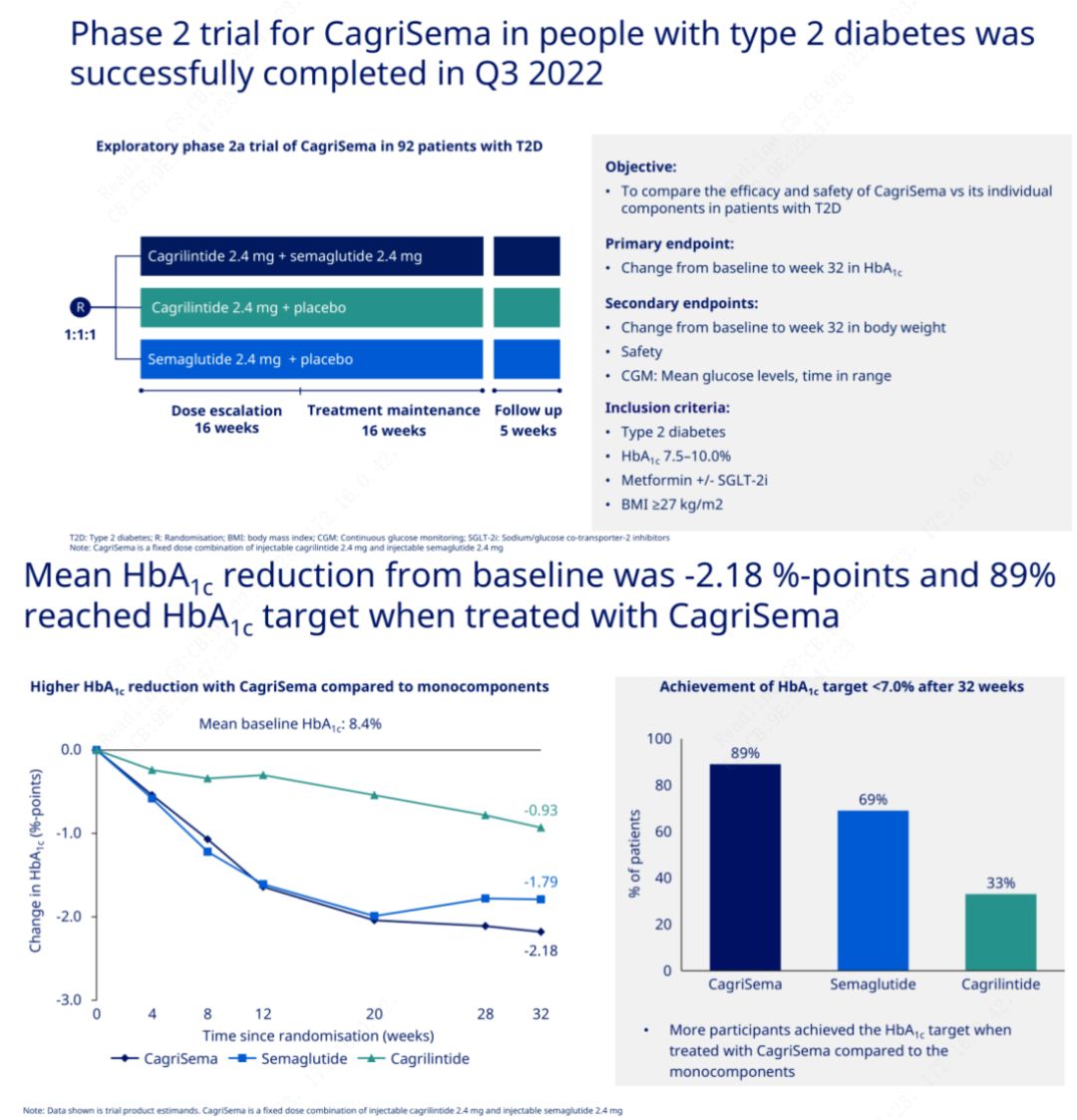
Los datos mostraron que, además del importante efecto hipoglucemiante, en términos de pérdida de peso, la inyección de CagriSema superó significativamente a la semeglutida (5,1%) y a la cagrilintida (8,1%) con una pérdida de peso del 15,6%.
El fármaco innovador Tirzepatida es el primer agonista semanal del receptor GIP/GLP-1 aprobado en el mundo.Combina los efectos de dos incretinas en una sola molécula que se inyecta una vez a la semana y es una nueva clase de tratamiento para la diabetes tipo 2.La tirzepatida fue aprobada por la Administración de Medicamentos y Alimentos de EE. UU. (FDA) en mayo de 2022 para mejorar el control glucémico (basado en la dieta y el ejercicio) en adultos con diabetes tipo 2 y actualmente está aprobada en la Unión Europea, Japón y otros países.
El 5 de julio, Eli Lilly anunció un estudio de fase III SURPASS-CN-MONO sobre la plataforma de divulgación de información y registro de ensayos clínicos de fármacos para el tratamiento de pacientes con diabetes tipo 2.SURPASS-CN-MONO es un estudio de fase III aleatorizado, doble ciego y controlado con placebo diseñado para evaluar la eficacia y seguridad de la monoterapia con tirzepatida en comparación con placebo en personas con diabetes tipo 2.El estudio planificó incluir a 200 pacientes con diabetes tipo 2 que no estaban tomando ningún medicamento antidiabético en los 90 días anteriores a la Visita 1 (excepto en ciertas situaciones clínicas, como enfermedad aguda, hospitalización o cirugía electiva, a corto plazo (≤14 días) uso de insulina).
Se espera que la diabetes tipo 2 se apruebe este año
El mes pasado, los resultados de un estudio SURPASS-AP-Combo se publicaron el 25 de mayo en la exitosa revista Nature Medicine.Los resultados mostraron que, en comparación con la insulina glargina, Tirzepatida mostró una mejor reducción de HbA1c y de peso en la población de pacientes con diabetes tipo 2 en la región de Asia y el Pacífico (principalmente China): reducción de HbA1c de hasta un 2,49 % y una reducción de peso de hasta 7,2 kg. (9,4%) a las 40 semanas de tratamiento, la mejora significativa de los lípidos en sangre y la presión arterial, y la seguridad y tolerabilidad generales fueron buenas.
El ensayo clínico de fase 3 de SURPASS-AP-Combo es el primer estudio de tirzepatida realizado principalmente en pacientes chinos con diabetes tipo 2, dirigido por el profesor Ji Linong del Hospital Popular de la Universidad de Pekín.SURPASS-AP-Combo es consistente con los resultados de la serie global de investigaciones SURPASS, que demuestra además que la fisiopatología de la diabetes en pacientes chinos es consistente con la de los pacientes globales, lo cual es la base para la investigación y el desarrollo simultáneos de nuevos medicamentos. en China y el mundo, y también proporciona evidencia sólida para brindar a los pacientes chinos la oportunidad de utilizar los últimos medicamentos para el tratamiento de la diabetes y su aplicación clínica en China lo antes posible.
Hora de publicación: 18-sep-2023

